> 造血干细胞人源化小鼠模型
| 品系名称 | 造血干细胞人源化小鼠模型 |
|---|---|
| 编号Number | |
| 英文名称English name | humanized-hematopoietic stem cells mice model |
| 常用名称Common name | |
| 基因信息Genetic information | |
| 疾病名称Disease name | |
| 制作类型Production type | 人源化 |
| 制作方法Making method |
1. 实验材料 1.1 实验动物 NPG小鼠购自北京维通达生物技术有限公司。 1.2 主要实验仪器 AriaII流式细胞仪 生物安全柜 涡旋混合仪 移液器 Rad Source RS2000系列生物学X-ray辐照仪 隔离器 2.实验操作规程和动物处理伦理 模型制作中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为BL18003。涉及人的生物医学伦理研究,批准号为BL23001。简要步骤如下: 2.1 纯化CD34造血干细胞 2.1.1 使用Miltenyi Biotec的CD34 MicroBead试剂盒纯化脐血来源的CD34造血干细胞。 2.1.2 用RPMI重悬细胞,放在冰上备用。 2.2 移植小鼠 2.2.1 使用X-ray辐照仪对NPG小鼠使用0.6 Gy的剂量进行全身照射。 2.2.2 从EP管中吸取1-2只量于注射器中,每只200ul,不宜吸入过多,以免细胞沉淀堵住注射器针口。 2.2.3 将小鼠固定于小鼠固定器中,尾巴通过固定器末端伸出,在距离鼠尾尖1/4至1/3处血管,持注射器向尾根部呈30°进针。 2.2.4 针头刺入确认有回血后,将细胞溶液匀速注入,注射后立即拔针用棉球止血。 2.3 检测人源化小鼠 2.3.1 移植后1月后进行检测,尾静脉抗凝采血。 2.3.2 将采集的血样进行裂红,加入ACK溶液裂红每管1ml,静待5分钟。 2.3.3 1500rpm离心5分钟,弃掉上清液 2.3.4 每个样本10μl加入流式抗体染色,4度30分钟。 2.3.5 加入1000μlPBST溶液离心,1500rpm离心5分钟。 2.3.6 上机测试样本。 2.3.7 数据分析,用人和小鼠的CD45检测,人CD45比例代表人源化比例。 |
| 背景品系Background lines | |
| 表型特征Phenotypic characteristics |
小鼠人源化比例检测
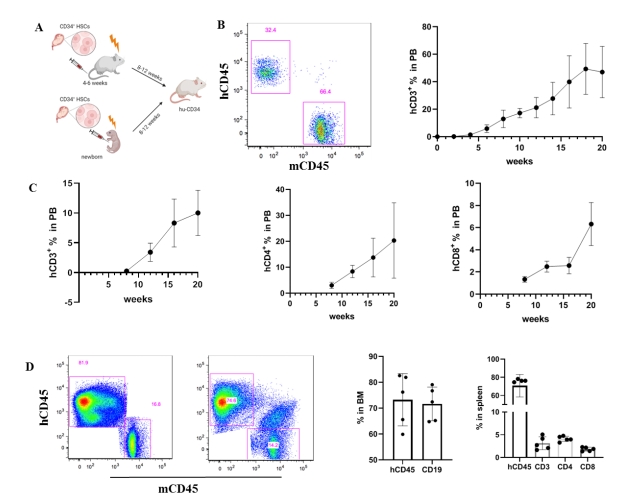
我们通过不同的免疫缺陷小鼠和不同来源的脐带血干细胞,确定NPG小鼠可以作为较合适的受体小鼠。通过2月龄成年小鼠移植和新生鼠胎肝移植的方式,确定两种方式均可稳定构建人源化小鼠模型。其中成年鼠移植可以较早的出现人源化细胞,并且比例相对较高。新生鼠胎肝移植的方式,人源化比例较低,但维持的时间较长,同时成本较低。我们构建人源化小鼠的方案如图1A,在细胞移植3周之后可以检测到人源的CD45阳性的细胞,比例随着时间不短增加,在10周左右趋于平稳,维持在30%-60%之间(图1B)。在8个月的时候仍然可以检测到人源的免疫细胞。同时在10周之后可以检测到CD4+、CD8+、CD3+的人源化细胞,比例在10%-20%之间(图1C)。细胞移植后20周,在人源化小鼠的骨髓和脾脏中能检测到80%和70%左右的人源化细胞,并且骨髓中B细胞比例为70%左右,脾脏中T细胞的比例为5%左右(图1D)。
图1 人源化小鼠构建策略及检测 |
| 引物序列Primer sequence | |
| 应用领域Application area | 为人类传染病研究、基因治疗和细胞治疗研究、肿瘤免疫研究、抗体药物研究提供动物模型。 |
| 繁殖方式Mode of reproduction | |
| 保存状态Save state | 活体 |
| 提供单位Provide unit | 中国医学科学院医学实验动物研究所 |
| 提供者Provider | |
| 参考文献Reference | Yue H, Bai L: Progress, implications, and challenges in using humanized immune system mice in CAR-T therapy-Application evaluation and improvement. Animal models and experimental medicine 2023 |
| 录入/更新时间Date | 2024.2.22 |
| 备注Remarks |

 当前位置:
当前位置: